Panduan Simulator Farmakokinetik: Praktikum Absorpsi, Distribusi, Metabolisme dan Ekskresi (ADME) Obat.
- dr. Penggalih M Herlambang, M.Kom
- dr. Putri Azalia, M.Biomed
- dr. Ahmad Muhyi, M.Biomed
Pentingnya Simulasi dalam Mempelajari Farmakokinetik
Farmakokinetik, yang mempelajari nasib obat di dalam tubuh melalui proses Absorpsi, Distribusi, Metabolisme, dan Ekskresi (ADME), merupakan pilar fundamental dalam ilmu farmakologi klinis. Namun, konsep-konsep seperti waktu paruh, volume distribusi, dan bioavailabilitas seringkali bersifat abstrak dan sulit untuk divisualisasikan hanya melalui teks dan diagram statis. Mahasiswa kedokteran dan farmasi sering menghadapi tantangan dalam menghubungkan teori ini dengan aplikasi klinis di dunia nyata, misalnya mengapa dosis obat perlu disesuaikan pada pasien geriatri dengan gangguan ginjal atau mengapa obat dengan metabolisme lintas pertama yang tinggi memiliki dosis oral yang jauh lebih besar daripada dosis intravena.
Penggunaan teknologi simulasi interaktif, termasuk virtual patient dan laboratorium virtual, telah terbukti secara ekstensif menjadi metode pedagogis yang efektif dalam pendidikan profesi kesehatan. Studi meta-analisis menunjukkan bahwa pendidikan berbasis simulasi secara konsisten mampu meningkatkan pengetahuan, keterampilan, dan pada akhirnya, perilaku klinis mahasiswa dibandingkan dengan pendekatan tradisional. Keunggulan utamanya adalah kemampuannya menyediakan lingkungan belajar yang aman dan terkontrol, di mana mahasiswa dapat berlatih mengambil keputusan klinis, melakukan kesalahan, dan belajar dari konsekuensinya tanpa membahayakan pasien sungguhan. Platform ini secara efektif menjembatani kesenjangan antara pengetahuan teoretis yang didapat di kelas dan aplikasi praktis di dunia klinis, serta meningkatkan retensi pengetahuan dan keterlibatan mahasiswa dalam proses belajar.
Simulator farmakokinetik interaktif ini dirancang untuk menjembatani kesenjangan tersebut. Dengan menyediakan platform visual yang dinamis, mahasiswa dapat secara aktif memanipulasi berbagai parameter—seperti dosis, fungsi organ (hati dan ginjal), dan rute pemberian obat—lalu secara langsung mengamati dampaknya pada kurva konsentrasi obat dalam plasma. Pengalaman belajar aktif ini tidak hanya memperkuat pemahaman teoretis tetapi juga membangun intuisi klinis yang krusial. Mahasiswa dapat menjelajahi skenario “bagaimana jika” secara aman, menginternalisasi hubungan sebab-akibat antara parameter fisiologis pasien dan profil farmakokinetik obat, sehingga mempersiapkan mereka untuk membuat keputusan terapi yang lebih rasional dan aman di masa depan.
Sumber Pustaka
- Bauer, L. A. (2019). Applied Clinical Pharmacokinetics. McGraw-Hill Education.
- Cendan, J., & Lok, B. (2012). The use of virtual patients in medical school curricula. Advances in Physiology Education, 36(1), 48-52.
- Cook, D. A., Hatala, R., Brydges, R., Zendejas, B., Szostek, J. H., & Erwin, P. J. (2011). Technology-enhanced simulation for health professions education: a systematic review and meta-analysis. JAMA, 306(9), 978-988.
- Katzung, B. G. (2018). Basic and Clinical Pharmacology. McGraw-Hill Education.
- McGaghie, W. C., Issenberg, S. B., Petrusa, E. R., & Scalese, R. J. (2010). A critical review of simulation-based medical education research: 2003–2009. Medical Education, 44(1), 50-63.
- Rowland, M., & Tozer, T. N. (2017). Clinical Pharmacokinetics and Pharmacodynamics: Concepts and Applications. Lippincott Williams & Wilkins.
1. Simulator Absorpsi (Bioavailabilitas & Rute Pemberian)
- Tujuan Pembelajaran:
- Membedakan profil farmakokinetik antara rute Intravena (IV) dan Oral (PO).
- Memahami konsep ketersediaan hayati/bioavailabilitas (F) dan faktor yang memengaruhinya.
- Memahami pengaruh laju absorpsi (Ka) terhadap Cmax dan Tmax (obat immediate vs. sustained release)
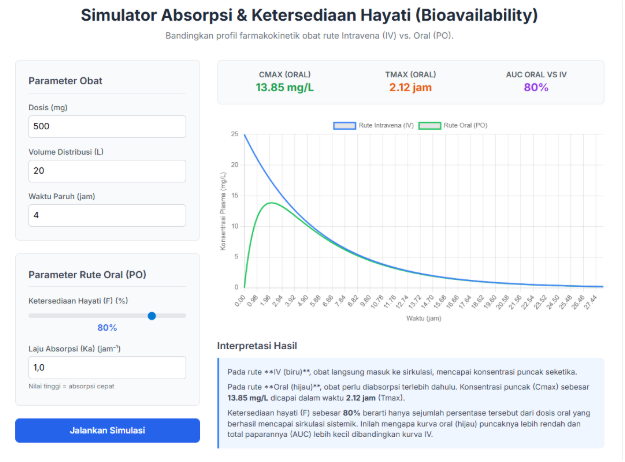
- Panduan Langkah-demi-Langkah:
- Buka simulator KLIK DISINI
- Atur parameter dasar obat (Dosis, Vd, Waktu Paruh).
- Gunakan slider untuk mengatur Ketersediaan Hayati (F) dan Laju Absorpsi (Ka).
- Klik “Jalankan Simulasi”.
- Bandingkan kurva Oral (hijau) dengan kurva IV (biru).
- Amati perubahan Cmax dan Tmax pada kotak info.
- Skenario Demonstrasi Kunci:
- Skenario A: Efek Bioavailabilitas
- Tunjukkan: Dengan F=100%, kurva oral (hijau) memiliki Area di Bawah Kurva (AUC) yang sama dengan IV (biru). Turunkan F menjadi 50%. Tunjukkan bahwa AUC kurva hijau kini hanya setengah dari kurva biru.
- Penjelasan: Ini adalah alasan mengapa dosis obat oral seringkali lebih tinggi daripada dosis IV untuk mencapai efek yang sama.
- Skenario B: Immediate vs. Sustained Release
- Naikkan Ka ke nilai tinggi (misal > 2.0). Tunjukkan kurva hijau menjadi “runcing” (Cmax tinggi, Tmax cepat). Ini adalah obat lepas cepat.
- Turunkan Ka ke nilai rendah (misal < 0.3). Tunjukkan kurva hijau menjadi “landai” (Cmax rendah, Tmax lambat, durasi lebih panjang). Ini adalah prinsip obat lepas lambat.
- Skenario A: Efek Bioavailabilitas
- Sumber Pustaka & Prinsip Dasar
- Simulator ini menggunakan rumus Cockcroft-Gault untuk mengestimasi Bersihan Kreatinin (CrCl) dan model farmakokinetik satu kompartemen dengan eliminasi orde pertama untuk memprediksi perubahan waktu paruh obat.
- Model ini merupakan pendekatan fundamental yang umum digunakan untuk tujuan edukasi dalam farmakokinetik klinis. Prinsip dan formula yang digunakan merujuk pada pustaka standar di bidang farmakologi, di antaranya:
- Bauer, L. A. (2019). Applied Clinical Pharmacokinetics.
- Rowland, M., & Tozer, T. N. (2017). Clinical Pharmacokinetics and Pharmacodynamics: Concepts and Applications.
- Katzung, B. G. (2018). Basic and Clinical Pharmacology.
2. Simulator Distribusi (Waktu Paruh & Jendela Terapeutik)
- Tujuan Pembelajaran:
- Memahami konsep waktu paruh (T½) dan pengaruhnya terhadap durasi obat dalam tubuh.
- Memvisualisasikan konsep Jendela Terapeutik (rentang antara Konsentrasi Efektif Minimum/MEC dan Konsentrasi Toksik Minimum/MTC).
- Menganalisis mengapa obat dengan indeks terapi sempit lebih berisiko daripada obat dengan indeks terapi lebar.
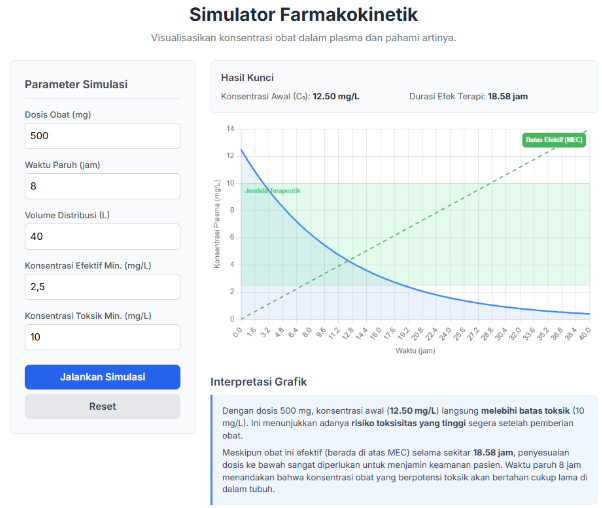
- Panduan Langkah-demi-Langkah:
- Buka simulator KLIK DISINI
- Atur parameter Dosis, Waktu Paruh, dan Volume Distribusi (Vd).
- Tentukan batas Konsentrasi Efektif (MEC) dan Konsentrasi Toksik (MTC) untuk mendefinisikan jendela terapeutik.
- Klik “Jalankan Simulasi”.
- Amati grafik konsentrasi (garis biru) dan bandingkan posisinya terhadap garis MEC (hijau) dan MTC (merah).
- Baca interpretasi otomatis di bawah grafik untuk analisis cepat.
- Skenario Demonstrasi Kunci:
- Skenario A: Obat Aman (Indeks Terapi Lebar)
- Parameter: Dosis: 1000mg, T½: 2 jam, Vd: 40L, MEC: 10 mg/L, MTC: 100 mg/L.
- Tunjukkan: Ada “ruang” yang sangat besar antara kurva obat dan batas toksik. Dosis ganda pun mungkin belum menyebabkan toksisitas.
- Analogi: Seperti Parasetamol.
- Skenario B: Obat Berisiko (Indeks Terapi Sempit)
- Parameter: Dosis: 0.25mg, T½: 36 jam, Vd: 500L, MEC: 0.8 ng/mL, MTC: 2.0 ng/mL. (Catatan: satuan harus konsisten, jika perlu sesuaikan dosis agar Cmax terlihat jelas).
- Tunjukkan: Kurva konsentrasi sangat dekat dengan batas MEC dan MTC. Sedikit saja perubahan dosis dapat membuat obat menjadi tidak efektif atau malah toksik. Waktu paruh yang panjang juga menunjukkan obat bertahan lama di tubuh.
- Analogi: Seperti Digoxin.
- Skenario A: Obat Aman (Indeks Terapi Lebar)
- Sumber Pustaka & Prinsip Dasar
- Simulator ini menggunakan rumus Cockcroft-Gault untuk mengestimasi Bersihan Kreatinin (CrCl) dan model farmakokinetik satu kompartemen dengan eliminasi orde pertama untuk memprediksi perubahan waktu paruh obat.
- Model ini merupakan pendekatan fundamental yang umum digunakan untuk tujuan edukasi dalam farmakokinetik klinis. Prinsip dan formula yang digunakan merujuk pada pustaka standar di bidang farmakologi, di antaranya:
- Bauer, L. A. (2019). Applied Clinical Pharmacokinetics.
- Rowland, M., & Tozer, T. N. (2017). Clinical Pharmacokinetics and Pharmacodynamics: Concepts and Applications.
- Katzung, B. G. (2018). Basic and Clinical Pharmacology.
3. Simulator Metabolisme (Fungsi Hati)
- Tujuan Pembelajaran:
- Memahami konsep metabolisme lintas pertama (first-pass metabolism).
- Memvisualisasikan bagaimana gangguan fungsi hati (ringan hingga sirosis) mengubah profil farmakokinetik obat.
- Menekankan pentingnya penyesuaian dosis pada pasien dengan penyakit hati.
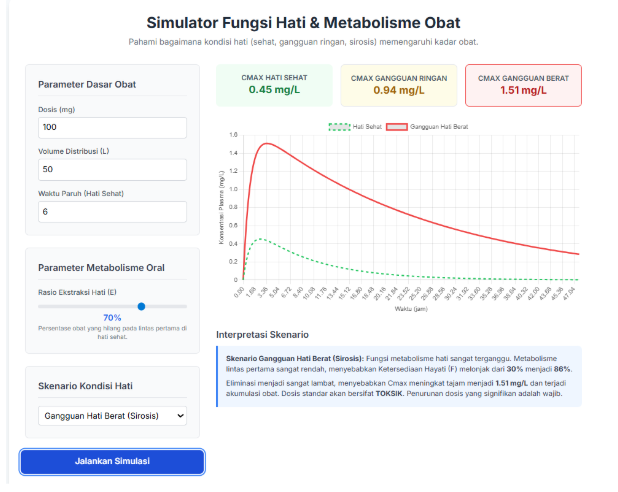
- Panduan Langkah-demi-Langkah:
- Buka simulator KLIK DISINI
- Atur parameter dasar obat dan Rasio Ekstraksi Hati (E).
- Pilih Skenario Kondisi Hati dari menu dropdown (Hati Sehat, Gangguan Ringan, Gangguan Berat).
- Klik “Jalankan Simulasi”.
- Amati perubahan kurva konsentrasi. Kurva “Hati Sehat” akan selalu ada sebagai pembanding (garis putus-putus).
- Baca interpretasi untuk memahami dampak klinisnya.
- Skenario Demonstrasi Kunci:
- Skenario A: Obat dengan First-Pass Metabolism Tinggi
- Parameter: Atur Rasio Ekstraksi (E) ke 90%. Pilih skenario “Hati Sehat”.
- Tunjukkan: Konsentrasi puncak (Cmax) sangat rendah karena sebagian besar obat dihilangkan oleh hati sebelum masuk sirkulasi.
- Skenario B: Pasien Sirosis
- Gunakan parameter yang sama, tapi ubah skenario menjadi “Gangguan Hati Berat (Sirosis)”.
- Tunjukkan: Kurva merah pasien sirosis melonjak sangat tinggi dibandingkan kurva pembanding (hijau putus-putus).
- Interpretasi: Jelaskan bahwa pada pasien sirosis, dua hal terjadi: (1) First-pass metabolism berkurang drastis, sehingga lebih banyak obat masuk ke darah, dan (2) eliminasi obat melambat, sehingga waktu paruh memanjang. Kombinasi ini sangat berbahaya dan dosis standar bisa menjadi sangat toksik.
- Skenario A: Obat dengan First-Pass Metabolism Tinggi
- Sumber Pustaka & Prinsip Dasar
- Simulator ini menggunakan rumus Cockcroft-Gault untuk mengestimasi Bersihan Kreatinin (CrCl) dan model farmakokinetik satu kompartemen dengan eliminasi orde pertama untuk memprediksi perubahan waktu paruh obat.
- Model ini merupakan pendekatan fundamental yang umum digunakan untuk tujuan edukasi dalam farmakokinetik klinis. Prinsip dan formula yang digunakan merujuk pada pustaka standar di bidang farmakologi, di antaranya:
- Bauer, L. A. (2019). Applied Clinical Pharmacokinetics.
- Rowland, M., & Tozer, T. N. (2017). Clinical Pharmacokinetics and Pharmacodynamics: Concepts and Applications.
- Katzung, B. G. (2018). Basic and Clinical Pharmacology.
4. Simulator Ekskresi (Fungsi Ginjal & Vankomisin)
- Tujuan Pembelajaran:
- Memahami peran ginjal dalam eliminasi obat.
- Menghitung Bersihan Kreatinin (CrCl) menggunakan rumus Cockcroft-Gault.
- Memvisualisasikan bagaimana penurunan fungsi ginjal menyebabkan akumulasi obat dan meningkatkan risiko toksisitas.
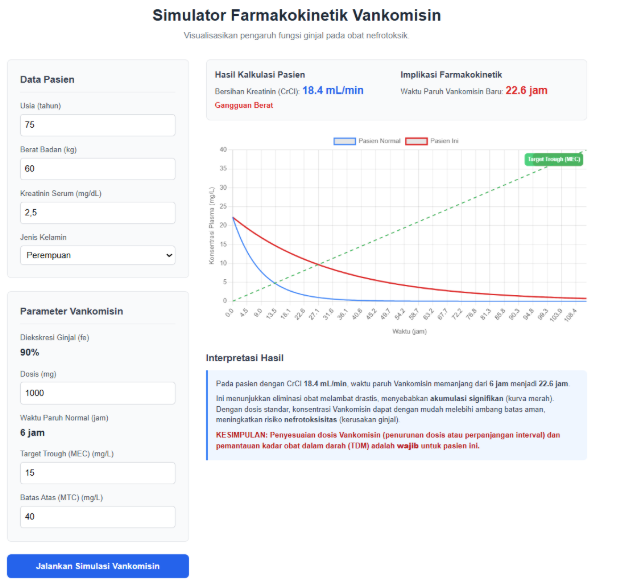
- Panduan Langkah-demi-Langkah:
- Buka simulator KLIK DISINI
- Masukkan data demografis pasien: Usia, Berat Badan, Jenis Kelamin, dan Kreatinin Serum.
- Parameter obat (Vankomisin) sudah diatur secara default.
- Klik “Simulasikan Ekskresi”.
- Bandingkan kurva pasien (merah) dengan kurva individu normal (biru).
- Perhatikan nilai CrCl yang dihitung dan interpretasi otomatisnya.
- Skenario Demonstrasi Kunci:
- Skenario A: Pasien Muda Sehat
- Parameter: Usia: 25 thn, Berat: 70 kg, Jenis Kelamin: Pria, Kreatinin: 1.0 mg/dL.
- Tunjukkan: CrCl tinggi (>90 mL/min). Kurva merah dan biru hampir tumpang tindih. Obat dieliminasi secara efisien. Dosis standar aman.
- Skenario B: Pasien Geriatri dengan Gangguan Ginjal
- Parameter: Usia: 80 thn, Berat: 55 kg, Jenis Kelamin: Wanita, Kreatinin: 2.8 mg/dL.
- Tunjukkan: CrCl sangat rendah. Kurva merah jauh lebih tinggi dan landai dibandingkan kurva biru.
- Interpretasi: Jelaskan bahwa obat terakumulasi secara berbahaya di dalam tubuh. Waktu paruh Vankomisin yang normalnya beberapa jam bisa memanjang menjadi beberapa hari. Ini adalah alasan klinis mengapa dosis Vankomisin wajib disesuaikan pada pasien ini.
- Skenario A: Pasien Muda Sehat
- Sumber Pustaka & Prinsip Dasar
- Simulator ini menggunakan rumus Cockcroft-Gault untuk mengestimasi Bersihan Kreatinin (CrCl) dan model farmakokinetik satu kompartemen dengan eliminasi orde pertama untuk memprediksi perubahan waktu paruh obat.
- Model ini merupakan pendekatan fundamental yang umum digunakan untuk tujuan edukasi dalam farmakokinetik klinis. Prinsip dan formula yang digunakan merujuk pada pustaka standar di bidang farmakologi, di antaranya:
- Bauer, L. A. (2019). Applied Clinical Pharmacokinetics.
- Rowland, M., & Tozer, T. N. (2017). Clinical Pharmacokinetics and Pharmacodynamics: Concepts and Applications.
- Katzung, B. G. (2018). Basic and Clinical Pharmacology.
Glosarium Istilah & Singkatan
- ADME: Singkatan dari Absorpsi, Distribusi, Metabolisme, dan Ekskresi. Empat proses utama yang menentukan nasib obat di dalam tubuh.
- AUC (Area Under the Curve): Area di Bawah Kurva konsentrasi-waktu. Merepresentasikan total paparan obat dalam tubuh dari waktu ke waktu.
- Bioavailabilitas (F): Ketersediaan hayati. Persentase (fraksi) dari dosis obat yang diberikan yang berhasil mencapai sirkulasi sistemik dalam bentuk tidak berubah. Untuk rute IV, F = 100%.
- Cmax: Konsentrasi plasma maksimum yang dicapai obat setelah pemberian.
- CrCl (Creatinine Clearance): Bersihan Kreatinin. Estimasi laju filtrasi glomerulus (GFR) ginjal, digunakan sebagai indikator utama fungsi ginjal.
- E (Extraction Ratio): Rasio Ekstraksi. Fraksi obat yang dihilangkan dari darah oleh satu organ (biasanya hati) saat darah melewatinya.
- First-Pass Metabolism: Metabolisme lintas pertama. Fenomena di mana konsentrasi obat, terutama saat diberikan secara oral, berkurang secara signifikan oleh hati sebelum mencapai sirkulasi sistemik.
- Ka (Absorption Rate Constant): Konstanta laju absorpsi. Menggambarkan seberapa cepat obat diabsorpsi dari tempat pemberian (misal, usus) ke dalam sirkulasi sistemik.
- MEC (Minimum Effective Concentration): Konsentrasi Efektif Minimum. Kadar terendah obat dalam plasma yang diperlukan untuk menghasilkan efek terapeutik.
- MTC (Minimum Toxic Concentration): Konsentrasi Toksik Minimum. Kadar terendah obat dalam plasma di mana efek toksik atau efek samping mulai muncul.
- T½ (Half-life): Waktu paruh. Waktu yang dibutuhkan agar konsentrasi obat dalam tubuh berkurang menjadi setengahnya.
- Tmax: Waktu yang dibutuhkan untuk mencapai konsentrasi plasma maksimum (Cmax) setelah pemberian obat.
- Vd (Volume of Distribution): Volume distribusi. Volume teoretis di mana obat terdistribusi dalam tubuh untuk menghasilkan konsentrasi yang sama seperti di plasma. Vd yang besar menandakan obat banyak terdistribusi ke jaringan.
